内容简介
最基本的细胞生物学过程取决于核酸和蛋白质之间的复杂相互作用,对这些相互作用的定量评估对于理解控制脱氧核糖核酸(DNA)复制、转录、重组或DNA修复的机制至关重要。而对生物分子的结构以及相互作用的评估很大程度上取决于光谱技术的发展。传统的振动光谱技术由于光学衍射极限的存在,最高空间分辨能力只能达到300nm(取决于激发源),获得整体水平上的平均化学信息,体光谱法在应用于生物异质系统(如DNA-蛋白质复合物)方面具有局限性。
近二十年来,纳米尺度光谱技术在单分子结构的检测方面体现出巨大潜力,应用纳米红外光谱技术(AFM-IR)已成为获得蛋白质纳米级空间分辨率成像及吸收光谱的有效工具。法国勃艮第大学卡诺跨学科实验室的Olivier Pietrement等人采用布鲁克纳米红外系统(nanoIR3)表征了DNA网络结构 和单个DNA分子的纳米光谱和吸收成像,相关成果发表以Infrared nanospectroscopic imaging of DNA molecules on mica surface为题,发表在Scientific reports上。
实验内容
作者采用亚精胺和Ni2+预处理云母表面,随后沉积DNA分子结构,采用纳米红外光谱技术分别对两种DNA分子结构进行纳米尺度化学表征。
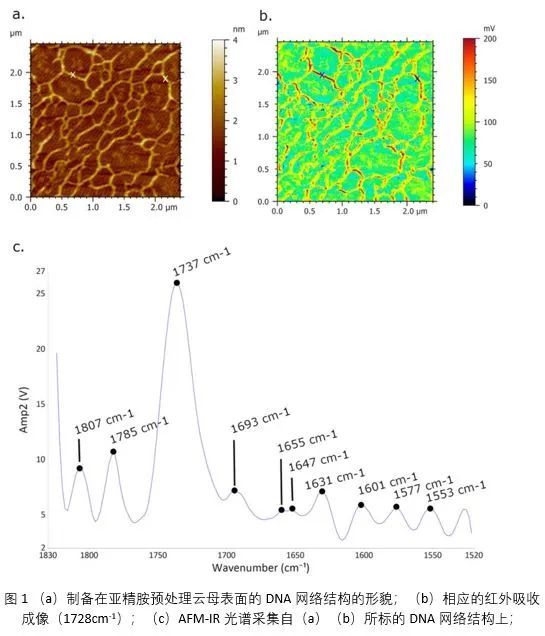
沉积在亚精胺官能化云母表面上的DNA分子呈现出多孔状的DNA网络结构,DNA分子相互吸引,但强度不足以产生完全球形的凝聚结构。图1(b)为采用1728cm-1波数的红外吸收对比成像,红-黄色代表较强的吸收,绿-蓝色代表吸收弱,红外成像图也清晰的展示出DNA的网络结构。纳米光谱(图1c)显示DNA分子上最强的吸收位于1700-1770cm-1,该宽吸收带由杂环基的C=O、C=C和C=N基团的重叠面内振动组成。此外,峰值在1693 cm−1的特征光谱来自腺嘌呤;1647 cm−1和1655 cm−1处的吸收带分别是胞嘧啶和酰胺I带的C2=O2中等强度拉伸的标志;在1630 cm−1附近发现一个与胺基团相关的低强度峰;而峰值位于1577 cm−1的吸收带与腺嘌呤的C=N振动拉伸有关。
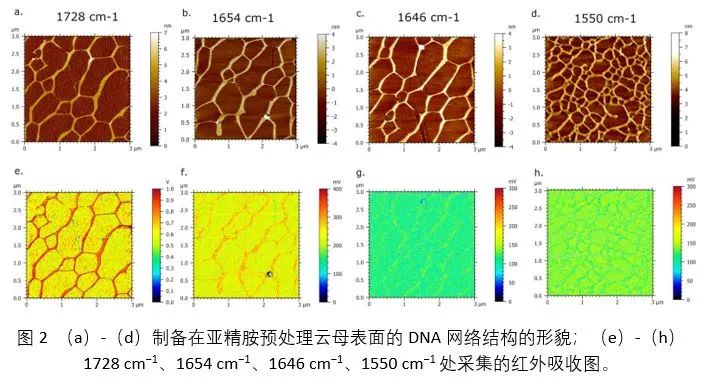
除此之外,作者将激光器调谐到固定波长,以评估DNA网络的红外吸收响应(图2)。在1728 cm−1、1654 cm−1和1646 cm−1处采集的AFM-IR图像都凸显了DNA网络结构,其中DNA在1728 cm−1处的红外吸收最高(图2e),而在1654 cm−1和1646 cm−1时逐渐衰减(图2f,g)。1550 cm−1处的AFM-IR红外吸收图像中背景的吸收较高,表明该波数的吸收可能源自云母表面的红外响应。
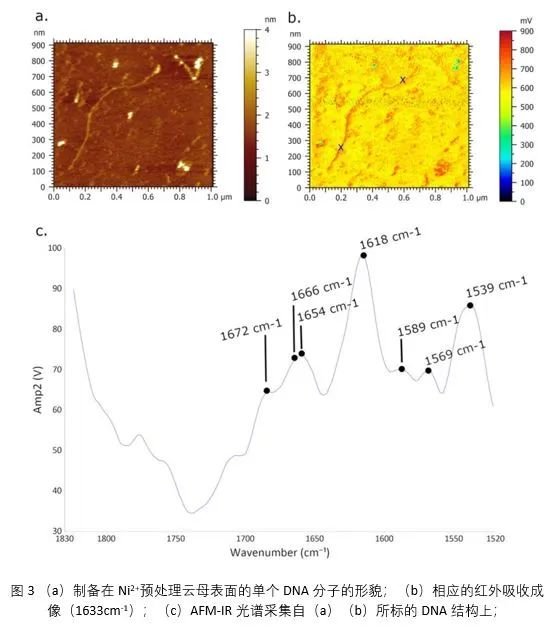
图3为制备在Ni2+预处理云母表面的单个DNA分子的纳米红外表征,红外吸收最大值为1618 cm−1。在1520–1558 cm−1之间的区域中观察到明显的吸收带,1539 cm−1处的吸收峰源于酰胺 II带;酰胺I带的特征吸收位于1640–1670 cm−1之间;在这段吸收带区间,观察到1654 cm−1和1664 cm−2两个峰值,以及1652 cm−1和1672 cm−1处的肩峰,分别对应于胞嘧啶的酰胺I和C2=O2。1568 cm−1处较弱的吸收峰对应于鸟嘌呤C=N环振动;在1589 cm−1处的吸收则归因于苯环C–C拉伸。
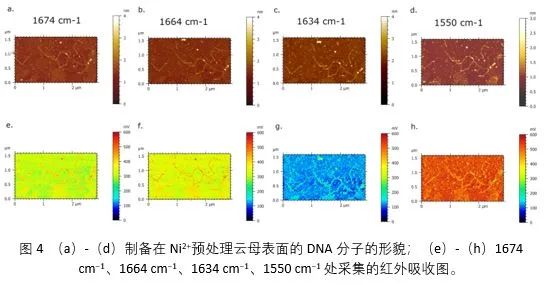
图4为1634 cm−1、1664 cm−1、1674 cm−1和1550cm−1处采集的单个DNA的红外吸收成像,分别代表鸟嘌呤的C6=O和胸腺嘧啶的C4=O、胞嘧啶的C2=O2、鸟嘌呤的C6=O和胸腺的C4=O的振动。
总结
作者首次使用AFM-IR以超高的空间分辨能力和灵敏度成功表征了DNA网络结构和单个DNA分子的纳米光谱和吸收成像。作者认为,AFM-IR纳米光谱技术可以成为化学修饰DNA和核蛋白复合物的光谱和成像表征的有效方法。
